Guten Abend Miteinander
Aufgabe: Es ist sehr gefährlich, «leere» Spraydosen ins Feuer zu werfen. Sie enthalten oft noch wenig Restflüssigkeit, die durch die hohe Temperatur verdampft und dadurch den Druck in der Dose massiv erhöht. Eine 3.00 dl fassende Flasche enthält 9.00 cm3 Wasser und 291 cm3 Luft von 20.0 °C. Beim Luftdruck 1000 hPa wird die Flasche hermetisch verschlossen und im Feuer auf 300 °C erhitzt. Dabei verdampft das Wasser vollständig. Wie gross wird der Druck in der Flasche?
Meine Frage / Lösungsweg:
Grundformel: pV =nRT
n1 = pV/RT => (100000Pa * 0.000291m3 )/(8.31*293) = 0.0119 mol luft
n2 = pV/RT => (100000Pa * 0.000009m3 )/(8.31*293) = 0.0003696 mol Wasser → das stimmt nicht, warum?
Wie komme ich sonst auf die Anzahl mol Wasser?
laut den Lösungen ist nGesamt = 0.5119 mol Gas.
Grundformel: pV =nRT
p2 = (nGesamt*R*T)/(V) = 81.3bar
Ich weiss, dass man diese Aufgabe mit dieser Gleichung löst?
pV=nRT
In meine Unterlagen wird n so definiert:
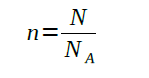
Was bedeutet N und was Na? Kann mir jemand mit dieser Aufgabe den Zusammenhang von n erklären oder was man sich unter n / N und Na vorstellen kann?
Vielen Dank im Voraus!
LG
Siemens