Aufgabe:
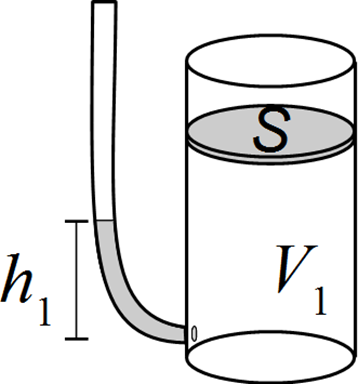
In einem gasdichten, mit einem Stempel (S) abgeschlossenen Behälter befindet sich ein ideales Gas, wobei sein Druck 1 bar = 100 kPa und sein Volumen V1 sind. Angeschlossen ist, über eine geeignete Trennmembran, als Druckmesser ein mit Wasser gefülltes Rohr (Wasserhöhe h1). Nun wird das Gasvolumen durch langsames Hereindrücken des Stempels um 2% komprimiert. Seine Temperatur ändert sich dabei nicht.Ungefähr um welche Höhe muss der Wasserspiegel im Druckmessrohr langsam erhöht bzw., erniedrigt (negative Werte) werden, um das Druckgleichgewicht zwischen V1 und Rohr zu erreichen? (Skizze nicht maßstabsgetreu)
Text erkannt:
S
Problem/Ansatz:
Ich weiß nicht, welches Gesetz ich hier verwenden muss bzw. wie ich herangehen soll.
Dank im Voraus