Guten Tag lul
Ich komme bei Ihrem Lösungsweg noch nicht ganz draus. Habe ich deinen Lösungsvorschlag so richtig umgesetzt?
Hier noch mein Versuch:
Grundsatz: ΔEabgegeben = ΔEaufgenommen
Formel: m * cp *(T1-T2) = m*cp*(T2-T1) + m *Lv
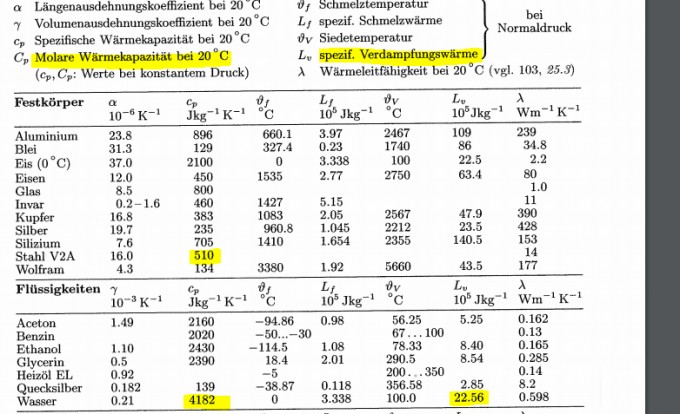
Nun habe ich die Zahlen eingesetzt.
6kg * 510 (J/KgK)* (1473K-373K) = 3kg*4182(J/KgK)*(373K-293K)+m*(2256000J/Kg)
m= 1.047Kg
Jedoch steht in den Lösungen 0.9Kg. Habe ich hier trotzdem richtig gerechnet?
Vielen Dank für deine Bemühungen!
LG
Siemens